【受付時間】 10:00〜18:00(土日祝日を除く)
【受付時間】 10:00〜18:00
(土日祝日を除く)
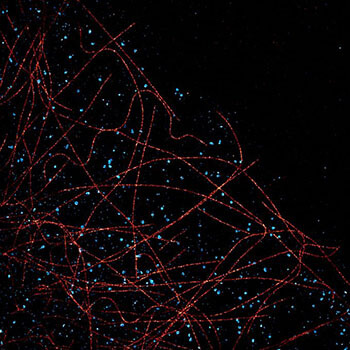
21世紀最初の10年間は、光学顕微鏡の目覚ましい向上が見られた時期でした。回折限界を打破した超解像顕微鏡技術がいくつも発明されたことで、蛍光顕微鏡法における空間的分解能は目覚ましい進歩を遂げ、超解像顕微鏡に関わる科学者がノーベル賞を受賞し注目されています。以下その経緯と最近の状況をまとめました。
執筆者:GATTAquant社(ドイツ) Dr. Carsten Forthmann
生産・ソフトウェア開発責任者
1.超解像顕微鏡以前
生物細胞の発見とその構造の最初の実験は、17世紀の顕微鏡の発明とその後の数年間の段階的な改良と強く結びついていた。これらの初期の顕微鏡はすべて、理論的には物体を自在に拡大できる、いわゆる光学顕微鏡であった。しかし、光学顕微鏡は、数ナノメートル以下の大きさの範囲で詳細を解像することはできない。この最小分解可能サイズは、Abbeの回折限界から生じ、試料の撮像に適用される光の波長に比例する。そのため、細胞内の構造や区画のほとんどは、一般的な光学顕微鏡を用いた詳細な方法には小さすぎる。
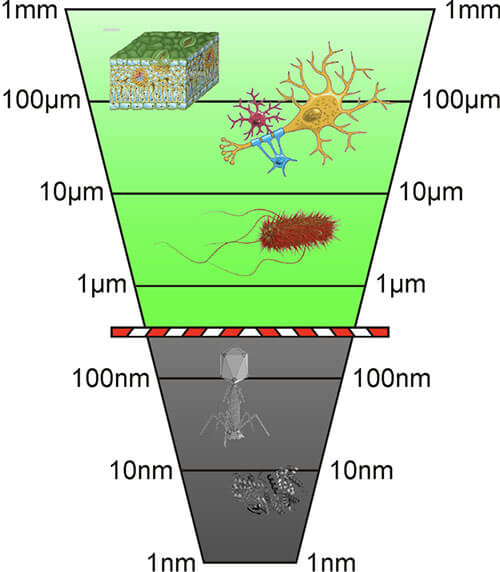
図1: 生命科学イメージングにおける問題としてのAbbeの回折限界の模式。
これが可能になったのは、1930年代に電子顕微鏡が開発されてからである。この手法では、光の代わりに視準された電子ビームを使用し、対象物を透過させるか (透過型電子顕微鏡、TEM)、対象物によって反射させる (走査型電子顕微鏡、SEM)。したがって、このような電子ビームの波長は可視光の波長よりもはるかに短く、解像度はそれぞれ高く、数ナノメートルの範囲で詳細なイメージングが可能となる。いわゆる原子間力顕微鏡 (AFM) では、さらに高い分解能に達することができるが、これは撮像される表面を極薄の針 (カンチレバー) で走査することによって機能する。カンチレバーと表面の間の力を測定することで、この顕微鏡は基礎構造の情報を取得する。したがって、これら2つの方法は、従来の光学顕微鏡では見ることができない細胞の下部構造の画像化を容易にする。しかし、電子顕微鏡の大きな欠点は、試料調製が非常に複雑であることと、侵襲性が非常に高いことである。したがって、この技術を生きた細胞に適用することはできない。また、AFMの場合、これらの問題は重大である。
そのため、光学顕微鏡の光学分解能を向上させる方法が、ここ数十年の間にいくつか開発された。いずれも、いわゆる蛍光顕微鏡に基づいている。蛍光顕微鏡は、ある波長の外光によって励起された後に発光する能力を持つ特殊な分子を対象として機能する。これらを画像化するためには、いわゆる蛍光色素または蛍光物質を目的の構造に結合させる必要がある。もちろん、蛍光顕微鏡は他の光学顕微鏡と同じ回折限界下にある。そのため、点状の光源は (蛍光色素分子と近似しているため)、点状の信号ではなく、ほぼガウスの強度分布を持つぼやけた画像を提示する。この分布はいわゆる「点広がり関数」 (PSF, Point spread function) によって記述され、その幅は放出光の波長に比例する。
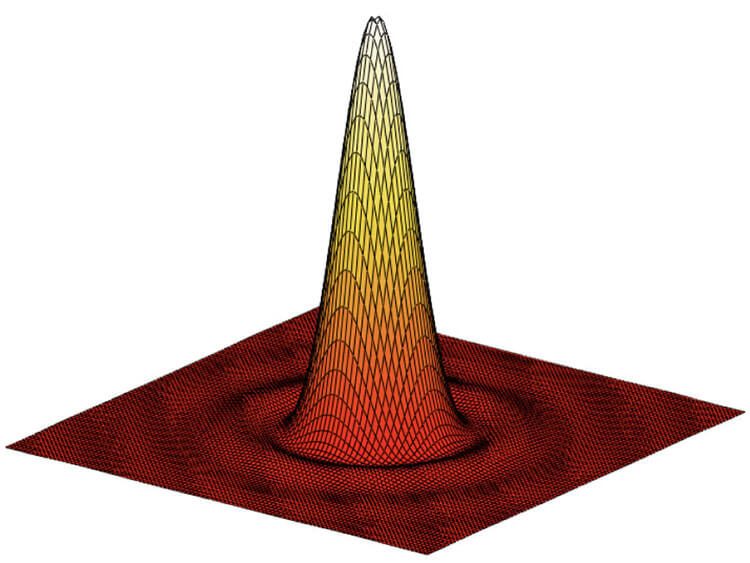
図2: 点広がり関数(PSF)の形状
分解能をわずかに向上させた最初の蛍光顕微鏡は共焦点顕微鏡で、1995年に開発された。この方法では、ほとんどの場合レーザーからの励起光で試料の特定のある点に焦点を合わせ、そこからのみ蛍光信号を検出する。その後、サンプルを通して焦点を走査することによって画像が生成される。Abbeの回折限界により、この焦点はもちろん実際の点ではなく、ガウス型PSFによって記述されるぼやけた強度分布となる。しかし、有効PSFは焦点PSFと検出PSFの積であるため、その幅は2の平方根の係数だけ減少する。しかし実際には、この効果は検出器の無限大によって多かれ少なかれ補償される。
2.回折限界の突破と各種技術
そして2000年に、共焦点顕微鏡が初めて回折限界を突破した。よって、これを最初の超解像技術と呼ぶことができる。このいわゆるSTED (誘導放出抑制) 顕微鏡は、誘導放出の効果に基づいている。ここでは、励起焦点に加えて、さらに長波長のドーナツ状の光の焦点が生成される。このSTEDビームの中心最小強度も回折によりぼやけている。しかし、その中心付近の直径がわずか数ナノメートルの小さな領域のほかに、STEDビームの強度は誘導放出によって蛍光物質がほぼ完全に抑制され、その蛍光を妨げるのに十分なほど高くなっている。したがって、ドーナツ型のSTED焦点の小さな中心に位置しない蛍光分子は、すべて暗い状態にある。この技術によって達成された分解能は約20nmである。

図3: はっきりとした有効PSFをもたらす、励起ビーム (A) 、ドーナツ型STEDビーム (B) および両方のオーバーレイ (C) によるSTED顕微鏡検査の動作原理。
共焦点顕微鏡だけでなく、近年の広視野顕微鏡でも、分解能を向上させる方法が開発されている。共焦点技術とは対照的に、広視野顕微鏡は試料の広範囲にわたる照明と、点検出器の代わりにカメラによる蛍光信号の検出で機能する。広視野設定の分解能を大幅に改善する最初のアプローチは、構造化照明顕微鏡 (SIM) であった。この手法では、サンプルを均一に照らすのではなく、縞模様のパターンで照らす。これは、一定の空間周波数をオブジェクトに追加することで、(物理的には有効口径部に位置する) フーリエ空間内のイメージが照明パターンの向きに応じて、より高い周波数の方向にシフトするというように解釈できる。励起パターンを回転させることにより、同じ周波数シフトを他の任意の方向に誘導することができる。これをすべての方向に対して行うと、直径が2倍に拡大された有効口径部領域が効果的に表示される。回折限界はこの値に比例するため、分解能はそれに応じて2倍向上する。

オブジェクト構造を全方向のより高い空間周波数にシフトすることで、有効口径サイズを効果的に2倍にしたSIMの動作原理
3.局在性顕微鏡法
しかし、この場合の解像度の障壁は移動しただけで実際には崩れていないため、SIMを超解像度技術と呼ぶかどうかは議論の余地がある。疑いなく超解像とみなすことができる最初の広視野アプローチは、局在性に基づく顕微鏡である。最も一般的な方法は、2006年に発明されたPALM (光活性化局在性顕微鏡法) とSTORM (確率的光学再構築顕微鏡法) である。いずれの技術も同じ原理に基づいて動作している。すなわち、回折限界のため、互いに近すぎる2つの蛍光分子は、PSFによって記述される信号が重複するために空間的に分解できない。しかし、単一のエミッタは、信号の幅よりもはるかに明瞭な精度で局所化できる。これは通常、ぼやけた信号分布にガウス関数を当てはめることによって行われる。このとき、一時的にエミッタを分離することができれば、その後にエミッタを局在化させることができる。その後、決定されたすべての単一蛍光物質の中心座標から、画像を再構成することが可能である。蛍光分子の時間的信号分離は、光物理スイッチングによって達成できる。これは、各蛍光物質が蛍光性のオン状態と非蛍光性のオフ状態の間を循環することを意味し、明滅する。平均オフタイムと平均オンタイムの比率が十分に高ければ、各取得フレームにおいて、サンプル中の色素分子のごく一部のみが、個々に局在化できるよく分離されたシグナルスポットで蛍光を発していることを確実にすることができる。数フレームを記録すると、すべての蛍光物質が局在化し、超解像画像を再構成することができる。実現可能な分解能はSTED顕微鏡に匹敵するため、約20nmの分解能が可能である。

図5: 局在化ベースの各超解像顕微鏡法の基本原理: 切り替えによる時間的分離は、再構成された超解像画像で生じるエミッタの個々の局在化を可能にする。
3Dイメージングは、PALMやSTORMでも可能である。そのため、例えば検出ビームパスに円筒レンズを入れることで、z位置に応じてPSFを成形することができる。これは信号点の可変楕円形を導き、そこからエミッタのz位置を既知のx座標とy座標に加えて導出し、3D超解像画像を再構成することができる。しかし、これらのスイッチングベースの局在化顕微鏡法にも、いくつかの欠点がある。最も明らかな欠点は、特に複数の異なる色素を同時に使用してマルチカラーイメージングを行う場合に、十分な明滅速度の調整が非常に困難になる可能性があるということである。また、光退色は、しばしば重大な問題となる。
これらの問題を克服した局在化ベースの超解像技術は、2010年に発明されたいわゆるDNA-PAINT顕微鏡法である。この方法も、再構成された超解像画像を生成する個々の蛍光物質の、その後の局在化の原理に基づいて機能する。DNA-PAINTとPALMまたはSTORMの主な違いは、明滅の誘発方法である。PALMとSTORMは蛍光物質の純粋な物理的スイッチングを利用しているが、DNA-PAINTでは色素分子は全く明滅せず、周囲の溶液から試料内部の特定の結合部位に、色素分子が一時的に結合および非結合することによって誘導される明滅のようなシグナルを与えるだけである。

図6: DNA-PAINTのスイッチング原理: 周囲の溶液から遊離した色素分子は構造に結合したり、結合しなかったりする。
新しい局在化のたびに新規に物理的蛍光物質が使用されるため、一方では長期的な光退色がほとんどなく、他方では局在化ごとにはるかに高い信号を得ることができ、より高い精度につながる。どちらの効果も画質が大幅に向上し、解像度も数ナノメートルの範囲で向上する。また、マルチカラー画像化は、DNA-PAINTでは物理的に単一の色だけで行うことができるため非常に簡単であるが、試料内の異なる構造タイプ間の別離は、色によってではなく、その後に画像化できる異なる結合シーケンスを使用することによって一時的に行われる。
2014年には、これらのすべての超解像技術はノーベル化学賞を受賞した。一方、ほとんどの方法では、市販のすぐに使えるデバイスが利用可能で、生命科学や医学研究の分野で広く使用されており、大きな進歩と多くの新しい発見をもたらしている。並列超解像イメージングは現在でもさらに発展し、改良されている。
4.MINFLUX
超解像顕微鏡の分野における最新の発明はMINFLUX (MINimal photon FLUXes) であり、基本的にはSTORMとSTEDの長所を組み合わせたものである。PALMやSTORMのように、MINFLUXは、個々の分子のオンとオフのスイッチングをランダムに行うことによって信号を一時的に分離することにより機能する。しかし、MINFLUXでの分子の局在化は、カメラで信号光子を収集し、その後、得られた分布をフィッティングすることによって受動的に行われるのではなく、STED顕微鏡で知られているようなドーナツ型のビームを適用することによって、能動的に行われるものであり、この場合、ビームは抑制のためではなく、励起のために使用される。ここでの主な原理は、蛍光物質を励起している間にドーナツ状の焦点が移動する一方で、この移動は分子の蛍光シグナルが0になるまで信号を最小化するように向けられている。これは、蛍光物質が正確に焦点の中心に位置した時に達成され、焦点の位置はナノメートル以下の精度で検知できるため、色素分子の位置も同様に判断できる。したがって、この技術は約1ナノメートルレベルの空間分解能を可能にし、さらに、他の超解像法とは対照的に信号を最小化するという基本原理により、必要な光子が非常に少ないため、光退色が大きな問題にならないという大きな利点がある。

図7: 単一蛍光色素のグリッドを使用したSTORMとMINFLUXの分解能比較。
しかし、主な欠点は、高度で非常に高価なセットアップ設計である。これが、この方法が未だに専門家に特化された技術であり、今のところより基本的な超解像方法とはなっておらず、研究で頻繁に使用されていない理由である。しかし、この技術をより簡単で使いやすいものにするための改良が進行中であり、近い将来、生命科学のあらゆる分野で強力な次世代イメージングツールになる可能性を間違いなく秘めている。
5.ナノルーラー 超解像顕微鏡 解像度評価ツール
超解像技術がいくつも発明されたことで、空間的分解能は目覚ましい進歩を遂げました。しかしながら、信頼のおけるツールがなかったことで、これらの新規技術の解像度が正しいものなのかを確認するのは困難でした。DNAオリガミによって製造された「ナノルーラー」は、2つの蛍光マーク間の距離が正確に定められ、色素分子をナノメートルレベルの正確さで配置することができます。
関連製品及び技術情報
●関連製品情報
DNA PAINTナノルーラー
DNA PAINTハイレゾナノルーラー
DNA PAINT 3Dナノルーラー
SIMナノルーラー
STEDナノルーラー
共焦点顕微鏡ナノルーラー
GATTABrightness
AFMナノルーラー
金ナノヘリックス
GATTA蛍光ビーズ
GATTA蛍光ビーズ W
GATTA CELL
DNA-PAINT専用 蛍光標識試薬 Massive Photonics
●技術情報
ナノルーラーの技術 DNA折り紙とは?
超解像イメージング用のツール
●カタログ
ナノルーラー総合カタログ
DNA PAINTナノルーラー
DNA PAINTハイレゾナノルーラー
DNA PAINT 3Dナノルーラー
SIMナノルーラー
STEDナノルーラー
共焦点顕微鏡ナノルーラー
GATTABrightness
AFMナノルーラー
金ナノヘリックス
GATTAビーズ
GATTAビーズ W
GATTA CELL
DNA-PAINT専用 蛍光標識試薬 Massive Photonics
●技術情報
お客様用ご相談/お問い合わせ
製品に関するご相談、デモ機器、お見積・納期などに関して お気軽に問い合わせ下さい
※は入力必須項目となります。


