タンパク質標識
過去数十年にわたって、蛍光顕微鏡は、細胞生物学や医学などの多くの科学分野で不可欠なツールになりました。蛍光顕微鏡は、従来の透過光型顕微鏡と比べてコントラストと感度が優れています。スペクトルの異なる蛍光マーカーを使用することによって、同一サンプル内の異なる標的を同時に観察することが可能になります。超解像顕微鏡(例:STED、dSTORM)とFRETは、タンパク質の細胞内プロセス、分布や構造動力学に関する他の方法では得られない情報が、自然光の回折限界をはるかに下回る低ナノメートルスケールで得られる蛍光技法のうち、最も広く用いられているものの例です。
目的タンパク質(POI)を蛍光標識するには、いくつかの方法があります。すなわち、蛍光有機色素との直接結合、自己標識タグ(SLP)または蛍光タンパク質とPOIとの融合、および免疫標識です。これらのどれについても、標識によるタンパク質機能の変化を防止することが極めて重要です。蛍光タンパク質の発見・導入は生細胞イメージングに革命をもたらしましたが、光物理的性能が不十分なこと(光退色が速い/輝度が低い)とサイズがかなり大きいことが、依然として多くのアプリケーションで制約となっています。対照的に、優れた光物理的特性を持つ広範な小型有機蛍光色素は、より優れた標識法となります。従来法による蛍光色素とのバイオカップリングは、タンパク質に自然に存在する反応基(チオールまたはアミン)と、対応する反応性蛍光物質誘導体(マレイミドまたはNHS-エステル、図1a)を利用します。
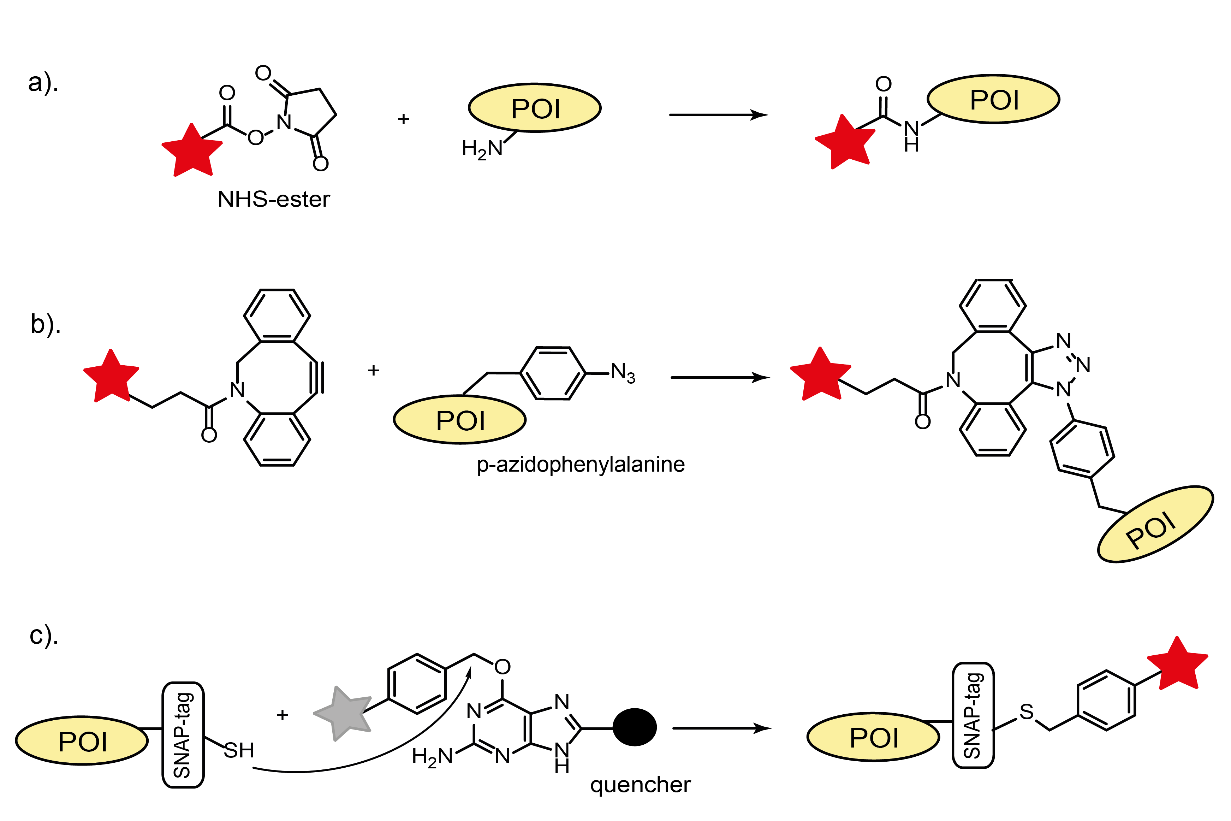
POIと色素とのこのような直接結合は、多くの場合、in vitroの研究や免疫染色用抗体の標識に関連しています。最近開発されたバイオ直交型カップリング法は、部位特異性と修飾反応の化学量論の制御の点でより優れています。その方法は、タンパク質合成中にユニークな化学基(例:パラアセチル部分またはパラアジド部分)を持つ非天然アミノ酸を組み込むことに基づいています。これらの化学基は、オキシム縮合またはクリックケミストリー反応において、それらの反応対象物と非常に特異的に反応します。加えて、歪み促進型銅フリークリック反応は、in vivoでの応用を容易にします(図1b)。SLP技術(Haloタグ、SNAPタグ、およびCLIPタグ)は、上記の3種類の標識法すべての利点を併せ持ちます。この方法は、反応性蛍光物質誘導体と融合POIのSLPタグとの間での特異的な共有結合形成に基づいています(図1c)。この技法は、生細胞と固定細胞の両方に使用可能です。最近のいわゆる蛍光発生標識の開発によって、蛍光ツールキットの幅はさらに拡大しました。これらの標識の特徴は、in vivoおよびin vitroで特定の標的に結合すると蛍光を発生する能力です。これによって、非特異的バックグラウンドが抑制されるので、画像のコントラストが高くなります。蛍光発生は、消光効果(PETまたはFRET)を有する隣接部分が、標識反応時に切断または構造変化を受けることによって起こります(図1c)。非天然アミノ酸または自己標識タグのカップリング化学反応は、発蛍光タンパク質標識に利用できます。用途に応じて、これら全ての標識方法から選択して組み合わせることができます。