【受付時間】 10:00〜18:00(土日祝日を除く)
【受付時間】 10:00〜18:00
(土日祝日を除く)
1.輸液の配合変化とは
医療現場で2種類以上の薬剤を混合した際、物理的あるいは化学的な変化が薬剤成分に対して起こることを薬剤の配合変化といいます。これは散剤(粉薬)、錠剤粉砕品、軟膏やクリーム剤など、様々な剤形の薬剤に関して起こりうるものですが、特に注射剤および輸液の配合変化は注意を要するものです。溶液状態であるため配合変化の物理反応あるいは化学反応が急速に進む可能性があるうえに、注射剤・輸液は薬剤を患者の血液中に直接投与するものであるので、患者にとって有害な配合変化である場合は患者に深刻な健康上の影響を及ぼす可能性があるためです。
2.薬剤師が輸液の配合変化を理解する必要性について
医療現場で医薬品を混合することは日常的にありますが、混合する薬剤の組み合わせや混合比率は患者ごとに異なるため、その都度、配合変化が起こる可能性を考える必要があります。代表的な配合変化については参考文献1) 等にまとめられていますが、それですべての可能性を網羅できているわけではありません。ここで薬剤師の知識や経験が非常に重要になってきます。医療チームの中でも「化学の専門家」である薬剤師は、混合する薬剤の物理化学的特性を把握し、それらを混合した場合に配合変化が起こる可能性を事前に予測できる存在であるべきです。薬剤の混合指示があったとき、薬剤師は配合変化を事前に予測し、医師や看護師に配合変化の注意喚起あるいは回避策や代替法の提言をする必要があります。
本記事では、輸液の配合変化として有名なネオフィリン®注(アミノフィリン注射液)とビタシミン®注射液(アスコルビン酸注射液)の配合変化について、ファイバー型近赤外分光器S-F2を用いて混合後の近赤外吸収スペクトルの経時的にモニタリングした結果について記述しています。
このように分光データの変化から配合変化を追跡することは、混合液の物理化学的変化を理解する上で極めて重要であると思われます。このようなデータの積み重ねが、薬剤師が配合変化を予測する上で役立つことを願っています。
3.ファイバー型近赤外分光器S-F2について
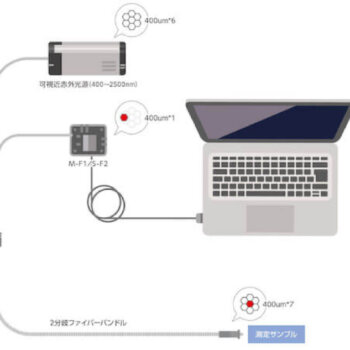
ファイバー型近赤外分光器S-F2は、光ファイバーを通して導かれた反射光(あるいは透過光)を分光し検出する小型分光器です。図1のように光源、測定プローブ、および分光器をY字の分岐ファイバーで接続し、検出データはUSB経由でPCに取り込み処理するという装置構成になります。
光源、分光器ともに非常に小型で、かつ測定プローブもコンパクトなので、極めて自由度の高い測定系の構築が可能です。
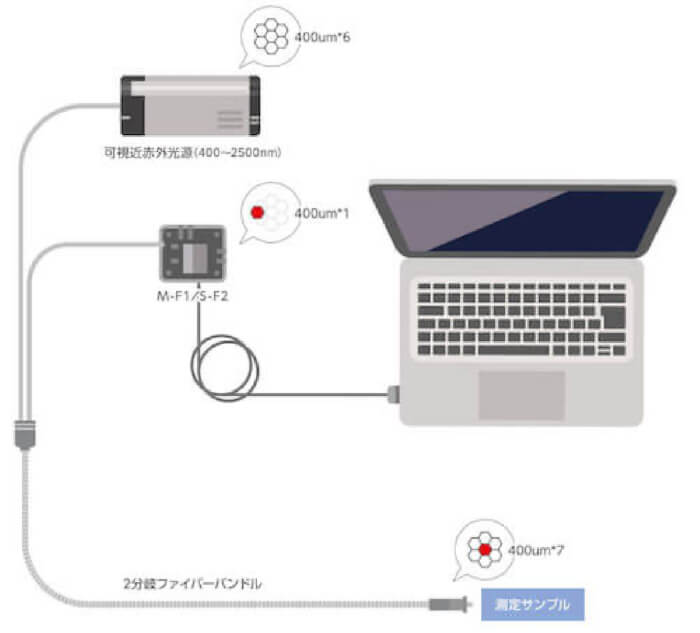
図1.ファイバー型近赤外分光器S-F2を用いた近赤外吸収スペクトル測定
4.今回取り上げる配合変化
今回のモニタリングでは、薬剤の化学構造が変化する化学的な配合変化をモニタリング対象として選択しました。配合変化には物理的変化(吸着、収着や溶解性変化に伴う析出など)と化学的変化(化合物の分解など)がありますが、化合物構造と密接に関わる近赤外吸収スペクトルの変化をモニタリングするのであれば、化学的な配合変化を対象とするのが適切と考えたためです。
化学的な配合変化の有名な例として、ネオフィリン®注(アミノフィリン注射液)とビタシミン®注射液(アスコルビン酸注射液)の配合変化2) があります。これは、両剤を混合後、まずアスコルビン酸のアルカリ分解により液が黄色に着色し、その後メイラード反応により赤褐色を帯びてくる3)、という化学的な配合変化です。着色という目視で分かりやすい配合変化であり、かつその化学的な反応過程が明らかになっており議論しやすいということで、この配合変化を題材として選択しました。
5.方法
ネオフィリン®注点滴用バッグ250 mg(エーザイ株式会社)の全量(250 mL)に、ビタシミン®注射液500mg(武田テバ薬品株式会社)の1/5バイアル分(0.4 mL、アスコルビン酸100 mg相当)を混合し、混合液を室温、暗所に静置しました。
ファイバー型近赤外分光器S-F2を光源A-LS2(InnoSpectra)および測定プローブとY字ファイバーで接続し、測定プローブを上記の混合液に浸漬させました。
装置全体は図2のような構成になります。図の装置構成全体を暗所に設置しています。

図2.輸液の配合変化をモニタリングする装置構成
測定プローブの先端が混合液に完全に浸かるように混合液に浸漬させています。測定プローブの先端のすき間(3 mm)部分(図3の「測定部」)の溶液を対象として近赤外吸収スペクトルを測定しています。近赤外吸収スペクトルはS-F2に付属する測定・解析アプリケーション「ISC NIRScan」を用いて測定しました。測定条件は以下の通りです。
- 波長範囲:900~1700 nm
- 露光時間:5.08 msec
- 測定ポイント数:228ポイント
- 測定回数:50回
- 総測定時間:74.758 sec

図3.混合液に浸漬させた測定プローブ
混合液の色調変化を混合後3、6、9、12、24時間後に確認しました。また近赤外吸収スペクトルは混合後24時間まで3時間おきに測定しました。各測定時間において3回繰り返して近赤外吸収スペクトル測定を行っています。
6.結果
ネオフィリン®注とビタシミン®注射液を混合後、24時間までの色調の変化は図4のようになりました。混合後9時間までは薄い黄色へと着色が進みましたが、その後24時間まででやや赤味を帯びた色へと変化していった様子を見て取ることができます。

図4.混合液の色調変化
混合後3時間おきに測定した近赤外吸収スペクトルについては、それぞれのスペクトルについて以下の手順で前処理を行っています。
① Savitzky-Golay法による平滑化と二階微分
② 1000~1300 nm領域を切り出し
③ 混合前のネオフィリン®注の近赤外吸収スペクトルに上記処理を行ったものとの差スペクトルを取得
その結果、図5のようなスペクトル経時変化が得られました。
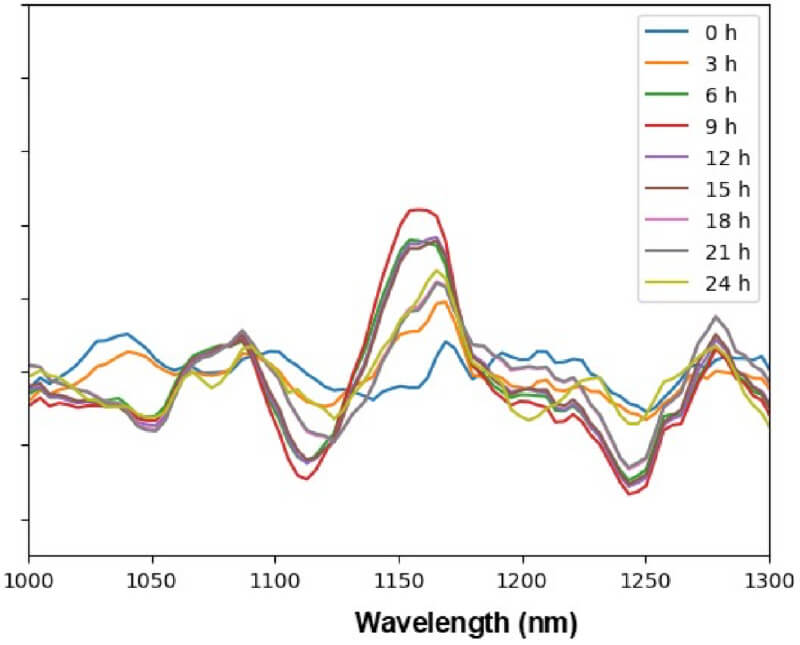
図5.混合液の近赤外吸収スペクトルの経時変化(縦軸は二階微分値の基準スペクトルとの差分)
この結果から、以下のようなスペクトルの経時変化を読み取ることができます。
- 1030 nm付近のピークは経時的に減少している
- 1100 nm~1250 nmにかけての「谷-山-谷」のスペクトル形状の振幅は、混合後9時間まで経時的に増加し、その後減少に転じている
- 混合後24時間のスペクトルで新たなスペクトル形状(1070 nmの谷、1200 nmの谷)が出現している
次に、得られた全てのスペクトルを対象として主成分分析(PCA)を行い、PC1からPC3の主成分を抽出しました(図6)。
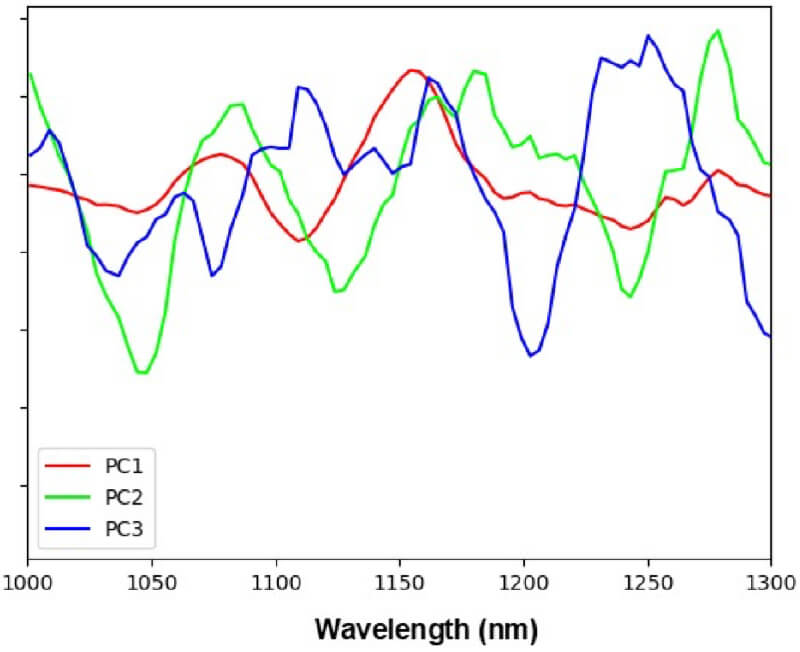
図6.測定データに対するPCAによる主成分(PC)抽出(縦軸は二階微分値の基準スペクトルとの差分)
得られたPC1からPC3のスコアを、混合後の経過時間に対してプロットすると図7のようになります。
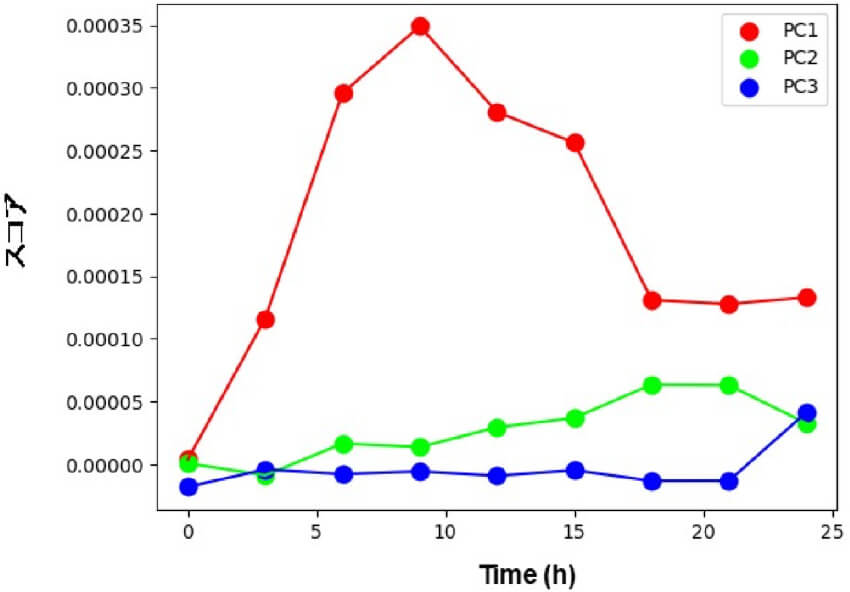
図7.各PCのスコア値の経時変化
図7より、PC1は混合後9時間までスコアが上昇し、その後減少していることがわかります。また、混合後24時間でPC2のスコアが減少し、PC3のスコアが上昇していることがわかります。これらの経時変化は、図5で見られたスペクトル形状の変化を定量的に示していると考えられます。
7.考察
今回はネオフィリン®注(アミノフィリン注射液)とビタシミン®注射液(アスコルビン酸注射液)の混合によって起こる着色を伴う化学的な配合変化を、ファイバー型近赤外分光器S-F2によって経時的に測定し解析しました。参考文献3) によると、この組み合わせの混合においては、まずアスコルビン酸のアルカリ分解によって黄着色がおこり、その後アスコルビン酸およびその分解物とネオフィリン®注に含まれるエチレンジアミンとのメイラード反応によって赤褐色に変化していくと考えられています。図4の色調変化の観察においても、混合後9時間あたりまでは混合液が黄着色し、その後24時間までに赤褐色を帯びていく様子が見てとれます。
混合後3時間おきに測定した近赤外吸収スペクトルに対して主成分分析(PCA)を行い、得られた主成分PC1からPC3を経時的にプロットすると(図7)、よりこの変化の様子がはっきりとわかります。すなわち、混合後9時間まではPC1のスコアが経時的に増加しその後減少しています。これは、PC1がアスコルビン酸のアルカリ分解による分解物に由来していると考えられます。混合後9時間以降にメイラード反応が進みアスコルビン酸分解物が消費されていき、混合後24時間に現れるPC2の減少とPC3の上昇の変化が、メイラード反応生成物に由来するものと考えられます。
このように、ファイバー型近赤外分光器S-F2を用いて輸液の混合による配合変化をモニタリングすると、内部で起きている化学変化を経時的および定量的に把握することができます。今回題材として用いたネオフィリン®注とビタシミン®注射液による配合変化以外のものについても、同様にファイバー型近赤外分光器を用いて分析することで、その物理化学変化を理解し把握することができると考えられます。このような分析と解析を積み重ねていくことが、薬剤師が臨床現場で配合変化を予測しその回避策を検討するための一助となることを願っています。
8.参考文献
1) 石井伊都子.注射薬調剤監査マニュアル2023.エルゼビアジャパン(2022).
2) 赤瀬朋秀,中村均.根拠からよくわかる注射薬・輸液の配合変化Ver. 2.羊土社(2017).
3) 山田正幸他.注射薬の配合変化について(1)-ビタミンCとネオフィリンによる着色の再検討-.J. Jpn. Soc. Hosp. Pharm.,19,861-864(1983).
お客様用ご相談/お問い合わせ
製品に関するご相談、デモ機器、お見積・納期などに関して お気軽に問い合わせ下さい
※は入力必須項目となります。